Translationale Forschung

Räumliche Erfassung von Tumorinfiltrierenden Lymphozyten (TILs) und anderen Entzündungszellen
Dr. med. Sören Schnellhardt
Immunzellen in räumlicher Nähe einer malignen Tumorerkrankung werden als Tumorinfiltrierende Lymphozyten (TILs) bzw. Tumorinfiltrierende Entzündungszellen bezeichnet. Sie sind nicht nur ein zentraler Akteur im sogenannten Tumormikromilieu, sondern korrelieren auch häufig mit dem Therapieansprechen, insbesondere in der Radiochemotherapie und Radioimmuntherapie. Sowohl ihre Dichte als auch ihre Lokalisation im und um das Tumorgewebe können als prognostische Marker für das Ansprechen auf diese Behandlungsmodalitäten dienen. Eine hohe Infiltration mit TILs kann sowohl mit verbessertem als auch mit reduziertem Therapieansprechen in Verbindung stehen. Wichtige Faktoren dabei sind die Art der untersuchten Entzündungszelle (z.B. T-Zellen, Makrophagen, neutrophile Granulozyten), die Tumorentität und ihre Subtypen sowie Immunphänotypen innerhalb des Tumors. Insbesondere bei Radioimmuntherapien, die auf die Aktivierung des Immunsystems abzielen, geht man von einer Schlüsselrolle von TILs in der Vermittlung der therapeutischen Wirkung aus.
Für die genaue Analyse von TILs werden immunhistochemische Färbungen eingesetzt, um einzelne Zellen in Tumorproben sichtbar zu machen. Hierbei werden Schnitte aus Tumorgewebe angefertigt und mit spezifischen Antikörpern gegen Proteine der untersuchten Zellart gefärbt. Die gefärbten Schnitte werden eingescannt und dann mittels KI-gestützter Bildanalysesoftware ausgewertet. Diese Methodik ermöglicht eine präzise Bestimmung der Dichte, Lokalisation und Verteilung von TILs im Tumorbereich. Die Untersuchung ihrer Interaktionen mit Tumorzellen und dem umgebenden Bindegewebe ist von zentraler Bedeutung, um die funktionellen Mechanismen der tumorgerichteten Immunantwort besser zu verstehen. Durch diese detaillierte Analyse kann nicht nur unser Verständnis von Vorgängen in der Tumormikroumgebung verbessert werden, sondern es können auch mögliche Vorhersagen über die Wirksamkeit von Radiochemotherapien und Radioimmuntherapien getroffen werden, was einen wichtigen Schritt in der Entwicklung neuer und personalisierter Therapieansätze darstellt.
Kontakt: E-Mail
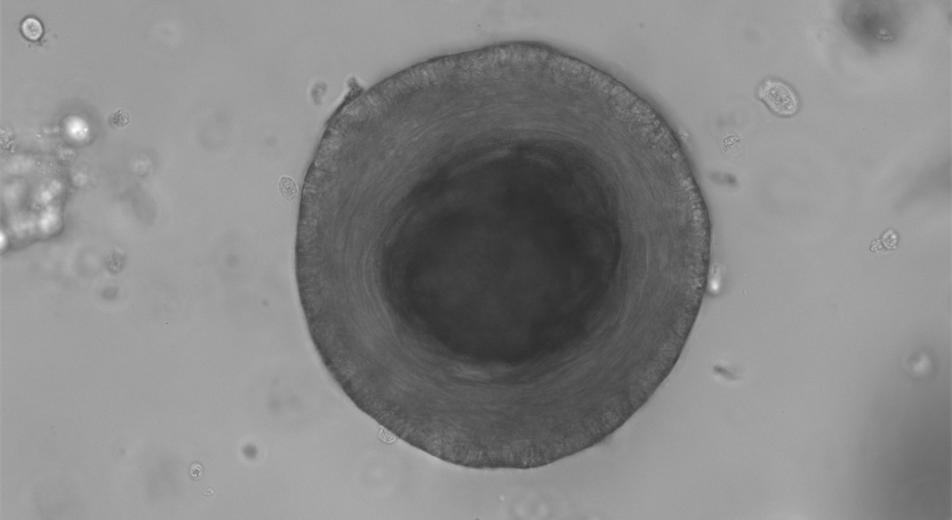
Generierung von Kopf-Hals-Tumor 3D-Kulturen als Modell zur Weiterentwicklung strahlentherapeutischer Therapieindividualisierung
Tobias Mohr
In Deutschland erkranken pro Jahr ca. 17.000 Menschen an Kopf-Hals-Tumoren (HNSCC), wovon ca. 7.100 an ihrer Krebserkrankung versterben. Global stellen HNSCC die sechst-häufigste Tumorentität dar. Trotz Verbesserung von Bestrahlungs- und Operationstechnik sowie der Zulassung eines EGFR-Antikörpers, konnte im Zeitraum 2013-2017 die 5-Jahres-Überlebensrate für Frauen lediglich von 59% auf 63% und für Männer von 45% auf 52% gesteigert werden. Mit der Zulassung von Immuncheckpoint-Inhibitoren (ICI) steht seit 2017 eine neue Therapieoption für die palliative Therapie von rezidivierten und/oder metastasierten Tumoren zur Verfügung. Allerdings sind bisher alle Studien zur Verbesserung der Heilungsrate durch Immuntherapie in kurativen Stadien, wenn auch nur knapp, gescheitert. Da grundsätzlich die Wirksamkeit von gegen PD-1 gerichteten ICI bei HNSCC gesichert ist, sind mechanistische Untersuchungen zur Integration dieser Substanzen in kurative Konzepte wie Radiochemotherapie und Möglichkeiten zur Therapieindividualisierung (z.B. durch Patientenselektion) essenziell, um die Erfolgschancen mit diesen Substanzen in neuen klinischen Studien zu erhöhen.
In diesem interdisziplinären Kooperationsprojekt erfolgt die Aufbereitung frischen Tumorgewebes von Kopf-Hals-Tumoren. Das Ziel ist die erfolgreiche Kultivierung der Zellen und die Etablierung eines stabilen patientenspezifischen 3D-Kultur-Modells für weitere Grundlagenforschung zur Tumorbiologie. Das Gewebe wird unmittelbar aus dem Operationsbereich zur weiteren Verarbeitung in die Laborräume überführt. In Matrigel erfolgt die Zellaussaat in einer kuppelförmigen extrazelluläre Matrix, die genetische Diversität und in-vivo Architektur nachahmen kann. Mehrere Testmedien und die Ko-Kultur mit humanen Fibroblasten wurden hier untersucht, um bestmöglichen Bedingungen für das Tumorwachstum zu gewährleisten. Nach erfolgreicher Etablierung von organisierten Tumorzellverbänden in Matrigel-Sphäroiden erfolgt eine Authentifizierung der Zelllinien mit zytomorphologischen, immunhistochemischen und genetische Untersuchung des Materials. Medienüberstand und Zellmaterial wird mittels PCR auf HPV und sofern nachweisbar weiter mittels in situ Hybridisierung zur Detektion des HPV-Genotyps untersucht. Geplant ist die weiterführende Untersuchung strahlenbiologisch wichtiger DNA-Reperaturproteine und der Seneszenz der Zellen.
Kontakt: E-Mail
