Forschungsprojekte
Prof. Dr. Claudia Rübe

Diese übergeordneten Forschungs- themen werden in unter- schiedlichen Forschungsprojekten untersucht:
Einflüsse strahleninduzierter, multipler und einzelner spezifisch targetierter DNA-Strangschäden auf die übergeordnete meso- und nanoskalige Chromatinarchitektur und die Topologie von Reparaturfoci
Referenz-Nr. 02NUK058B
Laufzeit: 2020 – 2024
Die strahleninduzierte Schädigung der genomischen DNA verändert lokal und meistens auch weitreichend die Chromatin-Architektur im Zellkern. Im Rahmen des Verbundprojektes wurden einzelne und multiple DNA-Schadensereignisse an definierten Stellen mittels spezifischen Oligonukleotiden erzeugt, die entsprechende Strahlenemitter tragen (Teilprojekt Jülich). Mittels hochauflösender Mikroskopie-Techniken, d.h. Mehrfarben-Fluoreszenz-Lokalisationsmikroskopie (Teilprojekt Heidelberg) sowie Elektronenmikroskopie (Teilprojekt Homburg) wurden topologische Chromatin-Veränderungen nach der DNA-Schädigung und während der Reparatur am Schadensort und in der Chromatin-Umgebung untersucht. Hierzu wurden die Topologien der Strangbrüche (Bruchenden), der Target-Regionen (γH2AX-Foci) und der Reparaturfoci (Rekrutierungsorte von Reparaturproteinen) im Euchromatin und Heterochromatin charakterisiert. Durch den systematischen Vergleich der hochauflösenden Mikroskopie-Verfahren wurden charakteristische Parameter der DNA-Reparatur im Kontext des Chromatins ermittelt und ihre Bedeutung für den Reparaturverlauf und die Strahlenantwort von Zellen erforscht.
BMBF-geförderte Publikationen:
- Studies on Human Cultured Fibroblasts and Cutaneous Squamous Cell Carcinomas Suggest That Overexpression of Histone Variant H2A.J Promotes Radioresistance and Oncogenic Transformation. Freyter BM, Abd Al-Razaq MA, Hecht M, Rübe C, Rübe CE. Genes (Basel). 2024 Jun 27;15(7):851. doi: 10.3390/genes15070851.PMID: 39062630
- Immunmodulatory Effects of Histone Variant H2A.J in Ionizing Radiation Dermatitis. Tewary G, Freyter B, Abd Al-razaq MA, Auerbach H, Laschke MW, Kübelbeck T, Kolb A, Mangelinck A, Kramer D, Rübe CE. Int J Radiat Oncol Biol Phys 2024 Mar, doi:10.1016/j.ijrobp.2023.09.022 PMID: 37758068
- Automated image Analysis of Transmission Electron Micrographs: Nanoscale Evaluation of DNA Damage in the Context of Chromatin. Abd Al-Razaq MA, Isermann A, Hecht M, Rübe CE. Cells. 2023 Oct doi: 10.3390/cells12202427. PMID: 37887271
- Role of Histone Variant H2A.J in Fine-Tuning Chromatin Organization for the Establishment of Ionizing Radiation-Induced Senescence. Abd Al-Razaq MA, Freyter BM, Isermann A, Tewary G, Mangelinck A, Mann C, Rübe CE. Cells. 2023 Mar 16;12(6):916. doi: 10.3390/cells12060916.PMID: 36980257
- Nuclear Fragility in Radiation-Induced Senescence: Blebs and Tubes Visualized by 3D Electron Microscopy. Freyter BM, Abd Al-Razaq MA, Isermann A, Dietz A, Azimzadeh O, Hekking L, Gomolka M, Rübe CE. Cells. 2022 Jan 13;11(2):273. doi: 10.3390/cells11020273.Cells. 2022. PMID: 35053389
- Focused Ion Microbeam Irradiation Induces Clustering of DNA Double-Strand Breaks in Heterochromatin Visualized by Nanoscale-Resolution Electron Microscopy. Lorat Y, Reindl J, Isermann A, Rübe C, Friedl AA, Rübe CE. Int J Mol Sci. 2021 Jul 16;22(14):7638. doi: 10.3390/ijms22147638.Int J Mol Sci. 2021. PMID: 34299263
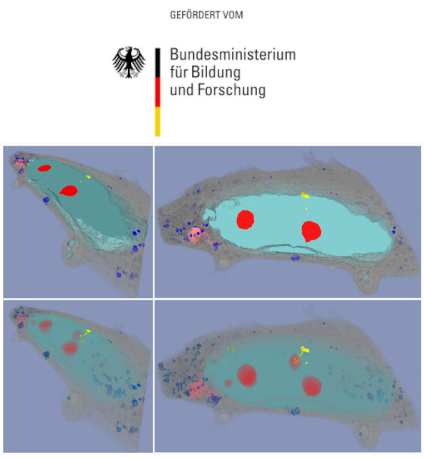
DNA-Reparaturfoci als Marker der individuellen Strahlenempfindlichkeit
Referenz-Nr.: 02NUK035A
Lauftzeit: 2014 - 2021
Durch die zunehmende Nutzung ionisierender Strahlen in der Medizin ist die zivilisatorische Strahlenbelastung der Bevölkerung in den letzten Jahren deutlich gestiegen. Die Strahlendosen reichen dabei von wenigen mGy (bei beruflich oder radiodiagnostisch bedingten Expositionen) bis hin zu mehreren Gy (im Rahmen einer Radiotherapie). Bei gleicher physikalischer Dosis können die biologischen Effekte einer Strahlen- exposition erheblich variieren, da große Unterschiede in der individuellen Strahlenempfindlichkeit existieren. Daher ist die Etablierung biologischer Marker für die Erfassung dieser individuellen Unterschiede dringend erforderlich. In der Strahlenbiologie erfolgt der Nachweis strahleninduzierter DNA Schäden als sog. Reparaturfoci mittels antikörperbasierter Immunfluoreszenz-Mikroskopie. Im Rahmen des Verbundprojektes wurden spezifische DNA Reparaturfoci (RF) als biologische Marker der individuellen Strahlenempfindlichkeit für verschiedene Fragestellungen validiert.
BMBF-geförderte Publikationen:
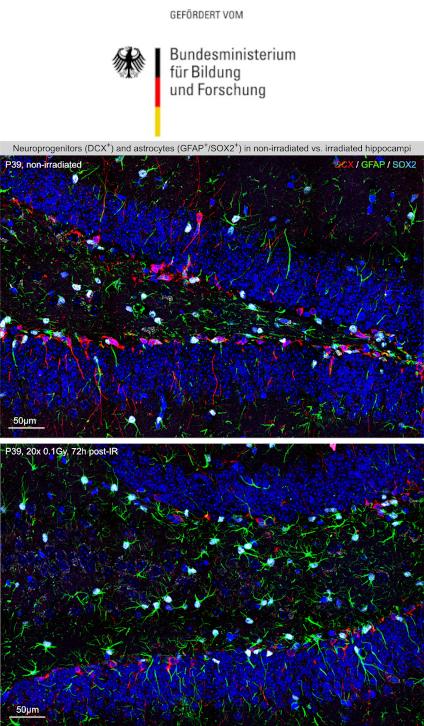
- Region-Specific Effects of Fractionated Low-Dose Versus Single-Dose Radiation on Hippocampal Neurogenesis and Neuroinflammation. Schmal Z, Rübe CE. Cancers (Basel). 2022 Nov 8;14(22):5477. doi: 10.3390/cancers14225477.PMID: 36428572
- Histone Variant H2A.J Is Enriched in Luminal Epithelial Gland Cells. Redon CE, Schmal Z, Tewary G, Mangelinck A, Courbeyrette R, Thuret JY, Aladjem MI, Bonner WM, Rübe CE, Mann C. Genes (Basel). 2021 Oct 22;12(11):1665. doi: 10.3390/genes12111665.PMID: 34828271
- Focused Ion Microbeam Irradiation Induces Clustering of DNA Double-Strand Breaks in Heterochromatin Visualized by Nanoscale-Resolution Electron Microscopy. Lorat Y, Reindl J, Isermann A, Rübe C, Friedl AA, Rübe CE. Int J Mol Sci. 2021 Jul 16;22(14):7638. doi: 10.3390/ijms22147638.PMID: 34299263
- Fractionated Low-Dose Radiation Induces Long-Lasting Inflammatory Responses in the Hippocampal Stem Cell Niche. Schmal Z, Hammer B, Müller A, Rübe CE. Int J Radiat Oncol Biol Phys. 2021 Dec 1;111(5):1262-1275. doi: 10.1016/j.ijrobp.2021.07.007. Epub 2021 Jul 16.PMID: 34280471
- Human skin aging is associated with increased expression of the histone variant H2A.J in the epidermis. Rübe CE, Bäumert C, Schuler N, Isermann A, Schmal Z, Glanemann M, Mann C, Scherthan H.NPJ Aging Mech Dis. 2021 Apr 1;7(1):7. doi: 10.1038/s41514-021-00060-z.PMID: 33795696
- Analysis of chromosomal aberrations and γH2A.X foci to identify radiation-sensitive ataxia-telangiectasia patients. Bucher M, Endesfelder D, Roessler U, Borkhardt A, Dückers G, Kirlum HJ, Lankisch P, Oommen PT, Niehues T, Rübe CE, Baumgartner I, Bunk F, Moertl S, Hornhardt S, Gomolka M.Mutat Res Genet Toxicol Environ Mutagen. 2021 Jan-Feb;861-862:503301. doi: 10.1016/j.mrgentox.2020.503301. Epub 2020 Dec 10.PMID: 33551102
- Histone Variant H2A.J Marks Persistent DNA Damage and Triggers the Secretory Phenotype in Radiation-Induced Senescence. Isermann A, Mann C, Rübe CE. Int J Mol Sci. 2020 Nov 30;21(23):9130. doi: 10.3390/ijms21239130.PMID: 33266246
- Individual response of humans to ionising radiation: governing factors and importance for radiological protection. Applegate KE, Rühm W, Wojcik A, Bourguignon M, Brenner A, Hamasaki K, Imai T, Imaizumi M, Imaoka T, Kakinuma S, Kamada T, Nishimura N, Okonogi N, Ozasa K, Rübe CE, Sadakane A, Sakata R, Shimada Y, Yoshida K, Bouffler S.Radiat Environ Biophys. 2020 May;59(2):185-209. doi: 10.1007/s00411-020-00837-y. Epub 2020 Mar 7.PMID: 32146555 Review.
- Assessment of DNA damage by 53PB1 and pKu70 detection in peripheral blood lymphocytes by immunofluorescence and high-resolution transmission electron microscopy. Lorat Y, Fleckenstein J, Görlinger P, Rübe C, Rübe CE. Strahlenther Onkol. 2020 Sep;196(9):821-833. doi: 10.1007/s00066-020-01576-1. Epub 2020 Jan 31.PMID: 32006067
- DNA damage accumulation during fractionated low-dose radiation compromises hippocampal neurogenesis. Schmal Z, Isermann A, Hladik D, von Toerne C, Tapio S, Rübe CE. Radiother Oncol. 2019 Aug;137:45-54. doi: 10.1016/j.radonc.2019.04.021. Epub 2019 May 4. PMID: 31063923
- Clustered DNA damage concentrated in particle trajectories causes persistent large-scale rearrangements in chromatin architecture. Timm S, Lorat Y, Jakob B, Taucher-Scholz G, Rübe CE. Radiother Oncol. 2018 Dec;129(3):600-610. doi: 10.1016/j.radonc.2018.07.003. Epub 2018 Jul 23.PMID: 30049456
- Increasing genomic instability during cancer therapy in a patient with Li-Fraumeni syndrome. Schuler N, Palm J, Schmitz S, Lorat Y, Rübe CE. Clin Transl Radiat Oncol. 2017 Nov 2;7:71-78. doi: 10.1016/j.ctro.2017.10.004. eCollection 2017 Dec.PMID: 29594232
- Hair Follicle Stem Cell Faith Is Dependent on Chromatin Remodeling Capacity Following Low-Dose Radiation. Schuler N, Timm S, Rübe CE. Stem Cells. 2018 Apr;36(4):574-588. doi: 10.1002/stem.2768. Epub 2018 Jan 12.PMID: 29282803
- Histone variant H2A.J accumulates in senescent cells and promotes inflammatory gene expression. Contrepois K, Coudereau C, Benayoun BA, Schuler N, Roux PF, Bischof O, Courbeyrette R, Carvalho C, Thuret JY, Ma Z, Derbois C, Nevers MC, Volland H, Redon CE, Bonner WM, Deleuze JF, Wiel C, Bernard D, Snyder MP, Rübe CE, Olaso R, Fenaille F, Mann C.Nat Commun. 2017 May 10;8:14995. doi: 10.1038/ncomms14995.PMID: 28489069
- Ultrastructural Insights into the Biological Significance of Persisting DNA Damage Foci after Low Doses of Ionizing Radiation. Lorat Y, Schanz S, Rübe CE. Clin Cancer Res. 2016 Nov 1;22(21):5300-5311. doi: 10.1158/1078-0432.CCR-15-3081. Epub 2016 May 19.PMID: 27199493
- Clustered double-strand breaks in heterochromatin perturb DNA repair after high linear energy transfer irradiation. Lorat Y, Timm S, Jakob B, Taucher-Scholz G, Rübe CE. Radiother Oncol. 2016 Oct;121(1):154-161. doi: 10.1016/j.radonc.2016.08.028. Epub 2016 Sep 13.PMID: 27637859
- Persistent DNA Damage in Spermatogonial Stem Cells After Fractionated Low-Dose Irradiation of Testicular Tissue. Grewenig A, Schuler N, Rübe CE. Int J Radiat Oncol Biol Phys. 2015 Aug 1;92(5):1123-1131. doi: 10.1016/j.ijrobp.2015.04.033. Epub 2015 Apr 25.PMID: 26059351
- Nanoscale analysis of clustered DNA damage after high-LET irradiation by quantitative electron microscopy--the heavy burden to repair. Lorat Y, Brunner CU, Schanz S, Jakob B, Taucher-Scholz G, Rübe CE.DNA Repair (Amst). 2015 Apr;28:93-106. doi: 10.1016/j.dnarep.2015.01.007. Epub 2015 Jan 28.PMID: 25659339
- Even low doses of radiation lead to DNA damage accumulation in lung tissue according to the genetically-defined DNA repair capacity. Flockerzi E, Schanz S, Rübe CE.Radiother Oncol. 2014 May;111(2):212-8. doi: 10.1016/j.radonc.2014.03.011. Epub 2014 Apr 17.PMID: 24746565
- DNA-damage foci to detect and characterize DNA repair alterations in children treated for pediatric malignancies. Schuler N, Palm J, Kaiser M, Betten D, Furtwängler R, Rübe C, Graf N, Rübe CE. PLoS One. 2014 Mar 17;9(3):e91319. doi: 10.1371/journal. pone.0091319. eCollection 2014.PMID: 24637877
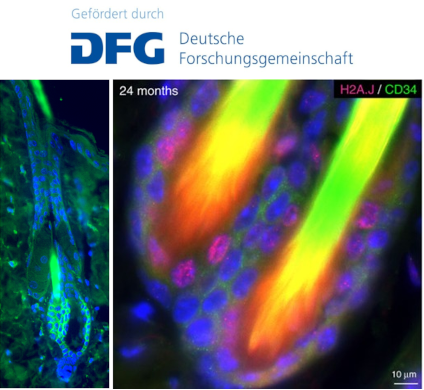
Die Pathophysiologische Bedeutung der Histonvariante H2A.J für die strahleninduzierte prämature Seneszenz
Referenz-Nr. RU 821/8-1
Laufzeit: 2018 – 2026
Die Spätnebenwirkungen nach Radiotherapie werden auf die Akkumulation dysfunktionaler, seneszenter Zellen und das reduzierte Proliferationspotential gewebespezifischer Stammzellen zurückgeführt, doch sind die genauen molekularen Pathomechanismen bislang unklar. In diesem Forschungsprojekt wird die pathophysiologische Bedeutung der Histonvariante H2A.J für die strahleninduzierte, prämature Seneszenz in-vitro und in-vivo untersucht. In einem Mausmodell wird die funktionelle Bedeutung von H2A.J im komplexen Gewebeverband der Haut während und nach fraktionierter Bestrahlung untersucht. In der murinen Epidermis sind die Haarfollikel mit ihrer Bulge‐Region ein ideales Organmodell für die Analyse von Differenzierungs-Prozessen epidermaler Stammzellen. Bei den unterschiedlichen Stammzell-Populationen wird der strahleninduzierte DNA-Schaden mit dem Chromatin-Einbau von H2A.J korreliert, und mit der Proliferation, der Differenzierung, sowie der Apoptose- bzw. Seneszenz-Induktion abgeglichen, um den Einfluss einer H2A.J Expression auf die Gewebehomöostase nach Strahlenexposition zu untersuchen. Um die spezifischen Funktionen von H2A.J in der Epidermis zu analysieren, wird bei transgenen H2A.J knock-out Mäusen geprüft, inwieweit bei fehlender H2A.J Expression eine prämature Seneszenz und dadurch bedingt eine verstärkte chronische Inflammation mit nachfolgender Fibrosierung der bestrahlten Haut induziert wird. Insgesamt soll die pathophysiologische Bedeutung der Histonvariante H2A.J für epidermaler Stamm-/Progenitor-Zellen analysiert werden, um potenzielle Ansatzpunkte für eine korrigierende pharmakologische Beeinflussung der Früh- und Spätnebenwirkungen einer Radiotherapie zu eröffnen.
DFG-geförderte Publikationen:
- Immunomodulatory Effects of Histone Variant H2A.J in Ionizing Radiation Dermatitis. Tewary G, Freyter B, Al-Razaq MA, Auerbach H, Laschke MW, Kübelbeck T, Kolb A, Mangelinck A, Mann C, Kramer D, Rübe CE. Int J Radiat Oncol Biol Phys. 2024 Mar doi: 10.1016/j.ijrobp.2023.09.022 PMID: 37758068
- Role of Histone Variant H2A.J in Fine-Tuning Chromatin Organization for the Establishment of Ionizing Radiation-Induced Senescence. Abd Al-Razaq MA, Freyter BM, Isermann A, Tewary G, Mangelinck A, Mann C, Rübe CE. Cells. 2023 Mar doi: 10.3390/cells12060916 PMID: 36980257
- Cultured Human Foreskin as a Model System for Evaluating Ionizing Radiation-Induced Skin Injury. Hippchen Y, Tewary G, Jung D, Schmal Z, Meessen S, Palm J, Rübe CE.Int J Mol Sci. 2022 Aug; doi: 10.3390/ijms23179830 PMID: 36077226
- Human skin aging is associated with increased expression of the histone variant H2A.J in the epidermis.Rübe CE, Bäumert C, Schuler N, Isermann A, Schmal Z, Glanemann M, Mann C, Scherthan H. NPJ Aging Mech Dis. 2021 Apr 1;7(1):7. PMID: 33795696
- Histone Variant H2A.J Marks Persistent DNA Damage and Triggers the Secretory Phenotype in Radiation-Induced Senescence. Isermann A, Mann C, Rübe CE. Int. J. Mol. Sci. 2020, 21(23), 9130. PMID: 33266246
- Histone variant H2A.J accumulates in senescent cells and promotes inflammatory gene expression. Contrepois K, Coudereau C, Benayoun BA, Schuler N, Roux PF, Bischof O, Courbeyrette R, Carvalho C, Thuret JY, Ma Z, Derbois C, Nevers MC, Volland H, Redon CE, Bonner WM, Deleuze JF, Wiel C, Bernard D, Snyder MP, Rübe CE, Olaso R, Fenaille F, Mann C. Nat Commun. 2017 May 10;8:14995. PMID: 28489069
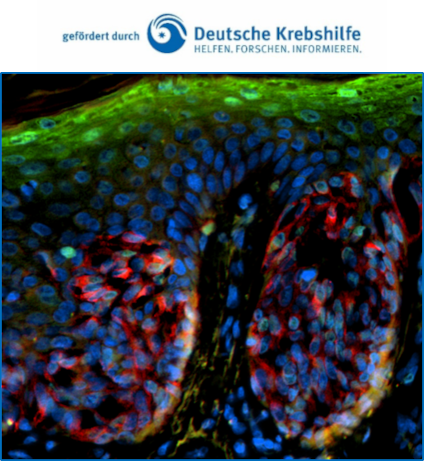
Die Bedeutung der prämaturen Seneszenz für die strahleninduzierte Hautreaktion im Rahmen fraktionierter Radiotherapie
Projekt-Nr. 70113135
Laufzeit: 2018 - 2025
Strahlungsbedingte Entzündungen mit nachfolgender Fibrosierung im Rahmen der fraktionierten Radiotherapie tragen entscheidend zur akuten und chronischen Schädigung des Normalgewebes bei, doch sind die genauen molekularen und zellulären Mechanismen insbesondere bei der strahleninduzierten Dermatitis nur unvollständig bekannt. Die normale Funktion der immun-inflammatorischen Reaktionen nach Bestrahlung besteht darin, geschädigte Zellen zu entfernen und eine normale Gewebereparatur einzuleiten. Allerdings kann eine chronische Aktivierung der Entzündung insbesondere im Rahmen der strahleninduzierten Seneszenz zu einer verstärkten Gewebe-Fibrosierung und potenziell auch zur Tumorentstehung beitragen. In früheren Arbeiten konnten wir zeigen, dass die Histonvariante H2A.J mit der zellulären Seneszenz assoziiert ist und entscheidend den Seneszenz-assoziierten sekretorischen Phänotyp (SASP) und somit der Sekretion pro-inflammatorischer Faktoren in der Haut moduliert. Chronisch inflammatorische Prozesse können die Entstehung von Hauttumoren begünstigen. Daher untersuchen wir in Kooperation mit der Klinik für Dermatologie (Direktor Prof. Vogt) die H2A.J Expression in dermalen Präkanzerosen (aktinische Keratose, Pigment-Nävi) und verschiedenen Hauttumoren (Plattenepithelkarzinom; Melanom), um die pathophysiologische Bedeutung von H2A.J für die Tumorgenese bzw. -progression zu untersuchen.
Publikationen
- Role of Histone Variant H2A.J in Fine-Tuning Chromatin Organization for the Establishment of Ionizing Radiation-Induced Senescence. Abd Al-Razaq MA, Freyter BM, Isermann A, Tewary G, Mangelinck A, Mann C, Rübe CE. Cells. 2023 Mar 16;12(6):916. doi: 10.3390/cells12060916.PMID: 36980257
- Cultured Human Foreskin as a Model System for Evaluating Ionizing Radiation-Induced Skin Injury. Hippchen Y, Tewary G, Jung D, Schmal Z, Meessen S, Palm J, Rübe CE. Int J Mol Sci. 2022 Aug 29;23(17):9830. doi: 10.3390/ijms23179830.PMID: 36077226
- Histone Variant H2A.J Is Enriched in Luminal Epithelial Gland Cells. Redon CE, Schmal Z, Tewary G, Mangelinck A, Courbeyrette R, Thuret JY, Aladjem MI, Bonner WM, Rübe CE, Mann C. Genes (Basel). 2021 Oct 22;12(11):1665. doi: 10.3390/genes12111665.PMID: 34828271
- Human skin aging is associated with increased expression of the histone variant H2A.J in the epidermis. Rübe CE, Bäumert C, Schuler N, Isermann A, Schmal Z, Glanemann M, Mann C, Scherthan H. NPJ Aging Mech Dis. 2021 Apr 1;7(1):7. doi: 10.1038/s41514-021-00060-z.PMID: 33795696
- Histone Variant H2A.J Marks Persistent DNA Damage and Triggers the Secretory Phenotype in Radiation-Induced Senescence. Isermann A, Mann C, Rübe CE. Int J Mol Sci. 2020 Nov 30;21(23):9130. doi: 10.3390/ijms21239130.PMID: 33266246
- Histone variant H2A.J accumulates in senescent cells and promotes inflammatory gene expression. Contrepois K, Coudereau C, Benayoun BA, Schuler N, Roux PF, Bischof O, Courbeyrette R, Carvalho C, Thuret JY, Ma Z, Derbois C, Nevers MC, Volland H, Redon CE, Bonner WM, Deleuze JF, Wiel C, Bernard D, Snyder MP, Rübe CE, Olaso R, Fenaille F, Mann C. Nat Commun. 2017 May 10;8:14995. doi: 10.1038/ncomms14995.PMID: 28489069

Low Dose Research towards Multidisciplinary Integration
Acronym: DoReMi
Project duration: 2010 - 2021
Accumulation of DNA damage in complex normal tissues after protracted low-dose radiation
The biological effects of low doses of ionizing radiation on the physiological function of normal tissues in living organisms are unclear. Ionizing radiation induces a variety of lesions of which DNA double-strand breaks (DSBs) are the biologically most significant, because unrepaired or misrepaired DSBs can lead to cell death and genomic instability. Using the laboratory mouse as an in-vivo system we established innovative and ultrasensitive methods to analyze the DNA damage response mechanisms in tissue-specific stem cells and differentiated cells of normal tissues chronically exposed to low radiation doses (10 mGy/ 100 mGy low-LET). By immunofluorescence microscopy DNA damage foci (γH2AX, 53BP1) are enumerated to monitor radiation-induced DSBs and to quantitatively study their accumulation in stem and differentiated cells within their physiological tissue context. To characterize these radiation-induced DNA lesions at the single-molecule level, we established a transmission electron microscopy (TEM) approach to localize gold-labeled repair components (γH2AX, 53BP1, MDC1, Ku70-Ku80, DNA-PKcs, pATM) within the chromatin ultra-structure. Using this innovative, technically delicate combination of light microscopy and electron microscopy, we aim to delineate the precise molecular mechanisms involved in the DNA damage response of tissue-specific stem and differentiated cells after protracted low-dose radiation. A more thorough understanding of the impact of low-dose radiation on complex living organisms will help to establish quantitative risk estimates for humans.
EU-funded publications:
- Fractionated low-dose radiation induces long-lasting inflammatory responses in the hippocampus. Schmal Z, Hammer B, Müller A, Rübe CE. Int J Radiat Oncol Biol Phys. 2021 Dec; doi: 10.1016/j.ijrobp.2021.07.007 PMID: 34280471
- DNA damage accumulation during fractionated low-dose radiation compromises hippocampal neurogenesis. Schmal Z, Isermann A, Hladik D, von Toerne C, Tapio S, Rübe CE. Radiother Oncol. 2019 Aug;137:45-54. PMID: 31063923
- Hair Follicle Stem Cell Faith Is Dependent on Chromatin Remodeling Capacity Following Low-Dose Radiation. Schuler N, Timm S, Rübe CE. Stem Cells. 2018 Apr;36(4):574-588. PMID: 29282803
- Ultrastructural Insights into the Biological Significance of Persisting DNA Damage Foci after Low Doses of Ionizing Radiation. Lorat Y, Schanz S, Rübe CE. Clin Cancer Res. 2016 Nov 1;22(21):5300-5311. Clin Cancer Res. 2016. PMID: 27199493
- Persistent DNA Damage in Spermatogonial Stem Cells After Fractionated Low-Dose Irradiation of Testicular Tissue. Grewenig A, Schuler N, Rübe CE. Int J Radiat Oncol Biol Phys. 2015 Aug 1;92(5):1123-1131. PMID: 26059351
- Even low doses of radiation lead to DNA damage accumulation in lung tissue according to the genetically-defined DNA repair capacity. Flockerzi E, Schanz S, Rübe CE. Radiother Oncol. 2014 May;111(2):212-8. PMID: 24746565
- Accumulation of DNA damage in complex normal tissues after protracted low-dose radiation. Schanz S, Schuler N, Lorat Y, Fan L, Kaestner L, Wennemuth G, Rübe C, Rübe CE. DNA Repair (Amst). 2012 Oct 1;11(10):823-32. PMID: 22947398
- Inducible response required for repair of low-dose radiation damage in human fibroblasts. Grudzenski S, Raths A, Conrad S, Rübe CE, Löbrich M. Proc Natl Acad Sci U S A. 2010 Aug 10;107(32):14205-10. PMID: 20660770
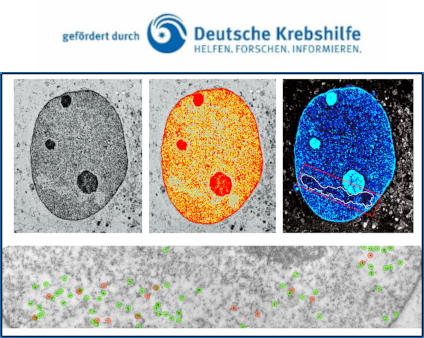
Die Reparatur von DNA-Schäden im Kontext des Chromatins
Laufzeit: 2016 - 2021
Die lokale Chromatin-Struktur besitzt eine essentielle Bedeutung für die Erkennung und Prozessierung von DNA Schäden. Im Rahmen einer DNA Schädigung führen lokale Modifikationen zu einer räumlichen Umstrukturierung des Chromatins, wobei diese Chromatin-Relaxation erst den Zugang der verschiedenen Reparaturproteine zur DNA Läsion ermöglicht. Aufgrund der extremen Kondensierung erscheint insbesondere das Heterochromatin als strukturelle Barriere für die Detektion und Prozessierung von DSBs. Durch ein komplexes Zusammenspiel von Chromatin-modifizierenden Faktoren wird die Chromatinstruktur aufgelockert bzw. geöffnet, so dass die einzelnen DNA Reparaturmechanismen ablaufen können. Eine entscheidende Herausforderung ist es, die genauen molekularen Zusammenhänge zwischen der vorliegenden Chromatinstruktur, den erforderlichen Chromatin-Modifikationen und den einzelnen DNA Reparaturprozessen hinsichtlich ihrer zeitlichen und räumlichen Koordination herauszuarbeiten. Daher etablierten wir in unserem Labor die hochauflösende Transmissions-Elektronenmikroskopie (TEM), um Immunogold-markierte DNA Reparaturproteine in der intakten Ultrastruktur des Zellkerns untersuchen zu können. Aufgrund der erheblich höheren Auflösung dieses TEM-Verfahrens sind im Vergleich zur Immunfluoreszenz-Mikroskopie (IFM) weitaus präzisere Analysen hinsichtlich der Prozessierung von DNA-Schäden möglich. So können die zentralen Reparaturproteine des NHEJ wie beispielsweise das Ku70-Ku80 Heterodimer und die DNA-PKcs, die am Bruch in so geringer Anzahl vorliegen, dass sie keine Fluoreszenz-mikroskopisch sichtbaren Foci ausbilden, nach einer Immunogold-Markierung mit Hilfe der TEM nachgewiesen werden. Darüber hinaus ermöglicht die TEM eine klare Differenzierung zwischen dicht-gepacktem Heterochromatin und locker-gepacktem Euchromatin. Auch kann die Chromatinstruktur durch spezifische Histonmodifikationen zusätzlich charakterisiert werden. Hierdurch können die molekularen Zusammenhänge zwischen den verschiedenen Reparaturproteinen und spezifischen Histonmodifikation funktionell charakterisiert werden. Insgesamt steht hiermit eine innovative, ultrasensitive Methode zur Verfügung, um die Mechanismen der DNA-Schadensantwort und insbesondere der DSB-Reparatur im Kontext des Chromatins zu untersuchen.
Publikationen:
- Focused ion microbeam irradiation induces clustering of DNA double-strand breaks in heterochromatin visualized by nanoscale-resolution electron microscopy. Lorat Y, Reindl J, Isermann A, Rübe C, Friedl A, Rübe CE. Int J Mol Sci. 2021,doi: 10.3390/ijms22147638 PMID: 34299263
- Assessment of DNA damage by 53PB1 and pKu70 detection in peripheral blood lymphocytes by immunofluorescence and high-resolution transmission electron microscopy. Lorat Y, Fleckenstein J, Görlinger P, Rübe C, Rübe CE. Strahlenther Onkol. 2020 Sep;196(9):821-833. PMID: 32006067
- Prevention of DNA Replication Stress by CHK1 Leads to Chemoresistance Despite a DNA Repair Defect in Homologous Recombination in Breast Cancer. Meyer F, Becker S, Classen S, Parplys AC, Mansour WY, Riepen B, Timm S, Ruebe C, Jasin M, Wikman H, Petersen C, Rothkamm K, Borgmann K. Cells. 2020 Jan 17;9(1):238. PMID: 31963582
- Clustered DNA damage concentrated in particle trajectories causes persistent large-scale rearrangements in chromatin architecture. Timm S, Lorat Y, Jakob B, Taucher-Scholz G, Rübe CE. Radiother Oncol. 2018 Dec;129(3):600-610. Radiother Oncol. 2018. PMID: 30049456
- Clustered double-strand breaks in heterochromatin perturb DNA repair after high linear energy transfer irradiation. Lorat Y, Timm S, Jakob B, Taucher-Scholz G, Rübe CE. Radiother Oncol. 2016 Oct;121(1):154-161. PMID: 27637859
- Nanoscale analysis of clustered DNA damage after high-LET irradiation by quantitative electron microscopy--the heavy burden to repair. Lorat Y, Brunner CU, Schanz S, Jakob B, Taucher-Scholz G, Rübe CE. DNA Repair (Amst). 2015 Apr;28:93-106. PMID: 25659339
- Beyond repair foci: DNA double-strand break repair in euchromatic and heterochromatic compartments analyzed by transmission electron microscopy. Lorat Y, Schanz S, Schuler N, Wennemuth G, Rübe C, Rübe CE. PLoS One. 2012;7(5):e38165. PMID: 22666473
- DNA repair in the context of chromatin: new molecular insights by the nanoscale detection of DNA repair complexes using transmission electron microscopy. Rübe CE, Lorat Y, Schuler N, Schanz S, Wennemuth G, Rübe C. DNA Repair (Amst). 2011 Apr 3;10(4):427-37. PMID: 21342792

