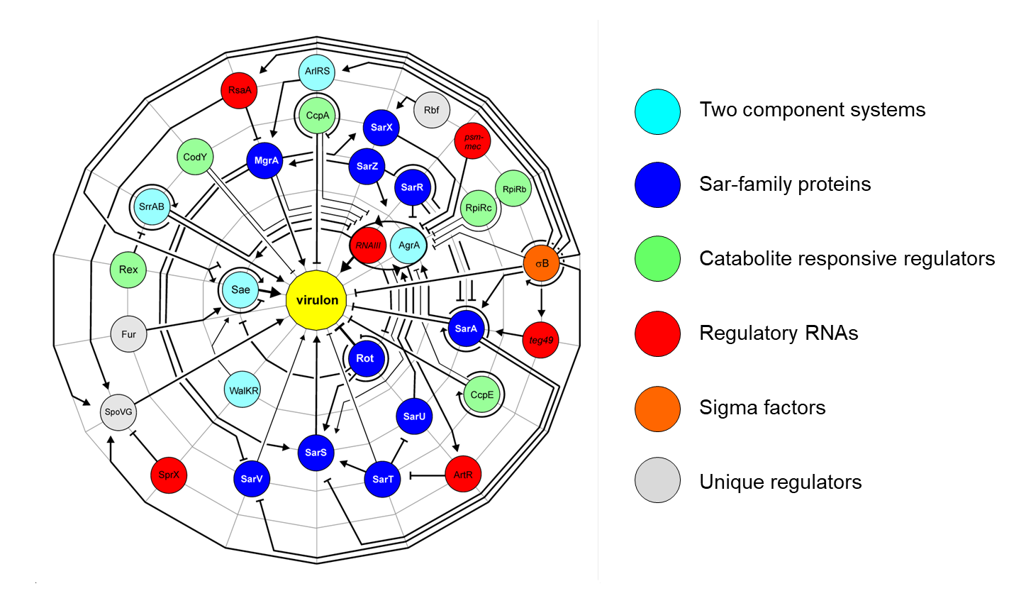
Regulatorische Netzwerke, die die Infektiosität von Bakterien und die Immunabwehr in Säugetierwirten beeinflussen
Ein wichtiger Vertreter der Gruppe der nosokomialen Krankheitserreger ist das Bakterium Staphylococcus aureus, ein häufiger Besiedler unseres Nasen-Rachen-Raums und gleichzeitig ein gefürchteter opportunistischer Erreger im Gesundheitswesen. Insbesondere bei immungeschwächten Menschen kann S. aureus lebensbedrohliche Krankheiten wie eine Endokarditis, Osteomyelitis oder eine Sepsis verursachen. Das grampositive Bakterium verfügt über ein umfangreiches Repertoire an Virulenzfaktoren und ein ausgeklügeltes Netzwerk an regulatorischen Molekülen, die es ihm ermöglichen, während des Infektionsprozesses schnell auf Veränderungen in der Umwelt bzw. im Wirt zu reagieren. In diesem Teil unserer Forschungsaktivitäten am IMMH sind wir an der Identifizierung und Charakterisierung von regulatorischen Faktoren und Phosphorylierungssystemen interessiert, die an der Pathogenese von S. aureus beteiligt sind. Wir interessieren uns insbesondere für Regulatoren, welche die Synthese von Virulenzfaktoren mit der Stoffwechselaktivität der Bakterienzelle verbinden. Ein weiterer Schwerpunkt unserer Staphylokokkenforschung sind Proteinkinase-/Phosphatasesysteme und ihre Auswirkungen auf die Infektiosität des Bakteriums. Potenziell interessante Gene werden gentechnisch inaktiviert und die daraus resultierenden Mutanten in einer Vielzahl von in vitro (z. B. Biofilm-Assays, Wachstumsstudien, Metabolom- und Transkriptomanalysen, Zellkultur-basierte Adhäsions- und Invasions-/Persistenzstudien) und in vivo Assays (z. B. Infektionsmodelle bei Mäusen) charakterisiert. Eine weitere wichtige Säule dieses Teils der IMMH-Forschung sind bakterielle Sekretionsfaktoren. Hier liegt unser Schwerpunkt darauf, wie der Wirt diese bakteriellen Stoffwechselprodukte erkennt und welche Immunreaktion(en) durch diese ausgelöst werden.
Wissenschaftler und Studenten, die sich für dieses Thema interessieren, sind herzlich dazu eingeladen, mit uns auf diesem spannenden Forschungsgebiet zusammenzuarbeiten. Bei Interesse nehmen Sie sehr gerne Kontakt mit uns auf.

Prof. Dr. sc. nat. ETH Markus Bischoff
Tel.: +49 (0) 6841 16-23963
Fax.: +49 (0) 6841 16-23985
E-Mail: markus.bischoff@uks.eu

Dr. rer. nat. Philipp Jung
Tel.: +49 (0) 6841 16-23904
Fax: +49 (0) 6841 16-23985
E-Mail: philipp.jung@uks.eu
Ausgewählte Veröffentlichungen von Mitgliedern unserer Forschungsgruppe zu diesem Thema:
Extracellular Release of a Disintegrin and Metalloproteinase Correlates With Periodontal Disease Severity
Ahmad Aljohmani, Hakon Heinze, Federico Guillermo Gharzia, Bashar Reda , Ahmed Mohamed Mostafa Abdrabou, Sören L Becker, Markus Bischoff, Matthias Hannig, Daniela Yildiz (2024)
J Clin Periodontol.
DOI: 10.1111/jcpe.14073
The secreted tyrosine phosphatase PtpA promotes S. aureus survival in RAW 264.7 macrophages through decrease of the SUMOylation host response
Nadhuma Youssouf, Marianne Martin, Markus Bischoff, Philippe Soubeyran, Laila Gannoun-Zaki, Virginie Molle (2023)
Microbiol Spectr. 11:e0281323
The transcription factor SpoVG is of major importance for biofilm formation of Staphylococcus epidermidis under in vitro conditions, but dispensable for in vivo biofilm formation
Hannah Benthien, Beate Fresenborg, Linda Pätzold, Mohamed Ibrahem Elhawy, Sylvaine Huc-Brandt, Christoph Beisswenger, Gabriela Krasteva-Christ, Sören L. Becker, Virginie Molle, Johannes K. Knobloch, Markus Bischoff (2022)
Int J Mol Sci. 23:3255
DOI: 10.3390/ijms23063255
Bitter taste signaling in tracheal epithelial brush cells elicits innate immune responses to bacterial infection
Monika I. Hollenhorst, Rajender Nandigama, Saskia B. Evers, Igor Gamayun, Noran Abdel Wadood, Alaa Salah, Mario Pieper, Amanda Wyatt, Alexey Stukalov, Anna Gebhardt, Wiebke Nadolni, Wera Burow, Christian Herr, Christoph Beisswenger, Soumya Kusumakshi, Fabien Ectors, Tatjana I. Kichko, Lisa Hübner, Peter Reeh, Antje Munder, Sandra-Maria Wienhold, Martin Witzenrath, Robert Bals, Veit Flockerzi, Thomas Gudermann, Markus Bischoff, Peter Lipp, Susanna Zierler, Vladimir Chubanov, Andreas Pichlmair, Peter König, Ulrich Boehm, Gabriela Krasteva-Christ (2022)
J Clin Invest. 132(13):e150951
DOI: 10.1172/JCI150951
The phosphoarginine phosphatase PtpB from Staphylococcus aureus is involved in bacterial stress adaptation during infection
Mohamed Ibrahem Elhawy, Sylvaine Huc-Brandt, Linda Pätzold, Laila Gannoun-Zaki, Ahmed Mohamed Mostafa Abdrabou, Markus Bischoff, Virginie Molle (2021)
Cells 10:645
Protein disulfide isomerase and extracellular adherence protein (Eap) cooperatively potentiate staphylococcal invasion into endothelial cells
Marleen Leidecker, Anne Bertling, Muzaffar Hussain, Markus Bischoff, Johannes A. Eble, Anke C. Fender, Kerstin Jurk, Christine Rumpf, Mathias Herrmann, Beate E Kehrel, Silke Niemann (2023)
Microbiol Spectr.11:e0388622
Staphylococcus aureus extracellular adherence protein (Eap) reduces immune cell phenotype in developing but not in established atherosclerotic lesions
Manuel Salzmann, Harald Platzer, Marion Mussbacher, Martina Derler, Max Lenz, Patrick Haider, Mira Brekalo, Julia B. Kral-Pointner, Stefan Kastl, Walter S. Speidl, Klaus T. Preissner, Uwe Schubert, Markus Bischoff, Pavel Uhrin, Johann Wojta, Philipp J. Hohensinner (2023)
Biochim Biophys Acta Mol Basis Dis. 1869(3):166616
Characterization of the secreted acid phosphatase SapS reveals a novel virulence factor of Staphylococcus aureus that contributes to survival and virulence in mice
Nour Ahmad-Mansour, Mohamed Ibrahem Elhawy, Sylvaine Huc-Brandt, Nadhuma Youssouf, Linda Pätzold, Marianne Martin, Noran Abdel-Wadood, Ahmad Aljohmani, Madjid Morsli, Gabriela Krasteva-Christ, Sören L. Becker, Daniela Yildiz, Jean-Philippe Lavigne, Laila Gannoun-Zaki, Markus Bischoff, Virginie Molle (2022)
Int J Mol Sci. 14;23:14031
Impact of the histidine-containing phosphocarrier protein HPr on carbon metabolism and virulence in Staphylococcus aureus
Linda Pätzold, Anne-Christine Brausch, Evelyn-Laura Bielefeld, Lisa Zimmer, Greg A. Somerville, Markus Bischoff, Rosmarie Gaupp (2021)
Microorganisms 9:466
Förderung
- Deutsche Forschungsgemeinschaft (DFG)
- UdS/HIPS Tandem