Smarte Implantate – Simulationsgestützte Personalisierte Unfallchirurgie
Kontakt

Projektträger
Kooperationen

Prof. Dr. Tim Pohlemann, Universitätsklinikum des Saarlandes, Klinik für Unfall-, Hand- und Wiederherstellungschirurgie

Prof. Dr.-Ing. Stefan Seelecke, Universität des Saarlandes, Lehrstuhl für intelligente Materialsysteme
Prof. Dr.-Ing. Phillipp Slusallek, Deutsches Forschungszentrum für Künstliche Intelligenz
Smarte Implantate
Smarte Implantate ist ein interdisziplinäres Projekt, das Kompetenzen aus Medizin, Materialwissenschaften, Mechanik und Informatik miteinander vereint. Ziel ist es die personalisierte Behandlung komplizierter Frakturen des Unterschenkels zu verbessern.
Im Zentrum des Projekts steht die Idee, Knochenheilung durch gezielte und angepasste Belastung des Frakturspalts positiv zu beeinflussen. Zu diesem Zweck soll ein neuartiges Implantat entwickelt werden, welches nicht nur aus mechanischer Sicht optimal auf die jeweilige Fraktur angepasst ist, sondern auch selbst durch aktive Bewegung und Versteifung unterstützend wirken soll. Hierbei kommt das intelligente Material Nickel-Titan (Nitinol) zum Einsatz, welches in der Form hauchdünner Drähte wie ein künstlicher Muskel wirken kann.
Weiterhin werden durch das Implantat oder auch sensorbestückte Einlegesohlen Daten zu Gangprofil und Belastung gesammelt, die mit Methoden der Künstlichen Intelligenz und Maschinellem Lernen patientenspezifisches Feedback und Heilungsprognosen erzeugen. Spezialisierte Simulationstechnik, welche die involvierten mechanischen Vorgänge möglichst präzise nachbildet, soll dabei die individuelle Optimierung des Implantats für jede Patientin und jeden Patienten bereits anhand herkömmlicher bildgebender Verfahren, beispielsweise der Computertomographie, ermöglichen.
Das Projekt wird mit 8 Millionen Euro durch die Werner Siemens-Stiftung gefördert.
Projektbeschreibung
Diaphysäre Tibiafrakturen sind eine häufige Frakturentität der unteren Extremität. Trotz der sich ständig weiterentwickelnden chirurgischen Möglichkeiten sind sie mit Verzögerungs- und Nicht-Heilungsraten von bis zu 10 Prozent und mehr verbunden. Derartige Komplikationen erfordern langwierige Behandlungen, oft verbunden mit weiteren Folgeeingriffen, die neben der hohen persönlichen Belastung auch mit direkten Behandlungskosten von über 12.000 Euro pro Patient verbunden sind und darüber hinaus indirekte Behandlungskosten verursachen, die geschätzt einen Faktor 10 höher liegen. Die Entwicklung von Nicht-Heilungen hängt von vielen Faktoren ab, die nur schwer zu beeinflussen sind: Alter, Geschlecht, Komorbiditäten, Genetik, Frakturmorphologie, sozioökonomischer Status und vieles mehr. Sobald eine Fraktur aufgetreten ist und chirurgisch behandelt wurde, ist die Heilung weitgehend abhängig von der Vaskularität und der mechanischen Frakturumgebung. Diese ist ein gemeinsames Produkt aus der gegebenen Fixationsmethode und der individuellen Aktivität des Patienten und erzeugt die interfragmentäre Bewegung („interfragmentary move IFM“), die als der einflussreichste mechanische Parameter im Heilungsprozess gilt. In moderaten Bereichen führt die interfragmentäre Bewegung zu einer erfolgreichen Frakturheilung, während eine zu niedrige oder zu hohe Bewegung zu einer Heilungsverzögerung führt, die in eine Nicht-Heilung mündet. Die Bestimmung und Analyse der interfragmentären Bewegung unter regulären klinischen Frakturbehandlungsbedingungen ist ohne spezielle Implantate, die auf hoch experimentelle klinische Studien bestimmter Frakturtypen beschränkt sind, nur schwer oder gar nicht möglich. Daher sind biomechanische Simulationen ein entscheidendes Werkzeug, um die mechanischen Fenster der Frakturumgebung zu bestimmen. Der Lasteintrag eines sich bewegenden Patienten, der als Randbedingung in die Simulationen einfließt, kann beispielsweise durch entsprechendes Monitoring verbunden mit Bewegungsanalysen auf der Basis des Körpergewichtes und der empfohlenen Belastungshöhe ermittelt werden. Derartige Szenarien erlauben den Aufbau und die Entwicklung eines Simulationsworkflows, der patienten-spezifisch die interfragmentäre Bewegung auf der Grundlage der individuellen Frakturgeometrie, der verwendeten Fixation und der im Monitoring erfassten Bewegungsdaten erlaubt. Zukünftig werden biomechanische Simulationen verstärkt genutzt werden, um beispielsweise neue Implantatsysteme unter Berücksichtigung der Frakturmechanik zu entwickeln, den potentiellen Heilungserfolg eines Patienten vorherzusagen oder um Patienten während der Physiotherapie Feedback zu geben.
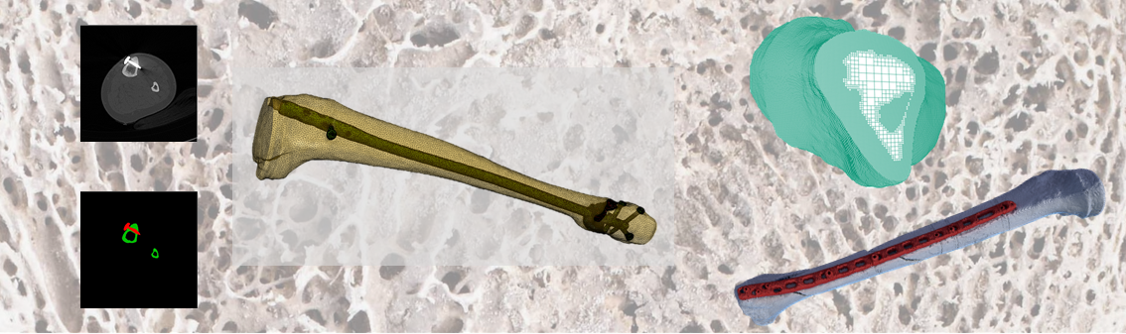
Den Ausgangspunkt des Simulationsprozesses bilden klinische 3D Bilddaten, beispielsweise CT- oder MRT-Datensätze, die in einem semi-automatischen Bildverarbeitung-Workflow segmentiert und aufbereitet werden. Anschließend werden die Bilddaten mit Hilfe eines Kalibrierungsphantoms, das während der CT-Aufnahme beigelegt wird, um die entsprechenden Knochendichte-Werte ergänzt, die in einem nachgelagerten Schritt in Materialparameter umgerechnet werden. Anschließend werden diese Informationen zusammen mit der Geometrieinformation in ein Finite Elemente Rechengitter überführt.

Abbildung 1 zeigt ein typisches CT-Bild eines Patienten mit einer intramedullären Marknagelversorgung. Im unteren Teil des Bildes kann man das bereits segmentierte Phantom erkennen, welches unter dem Bein des Patienten platziert ist. Des Weiteren zeigt Abbildung 1 eine ausschnitthafte Illustration des fertigen Computermodells nach erfolgter Erzeugung des Rechengitters.
Um die Simulationen weiter zu individualisieren, werden die Randbedingungen auf der Basis erhobener Monitoring-Daten berechnet. Dazu werden die Bewegungsdaten der Patienten in einem standardisierten klinischen Gangparcours aufgezeichnet und in ein muskuloskelettale Simulationssystem übertragen, welches die auftretenden Kräfte und Momente in den Gelenken simuliert.

Abbildung 2 zeigt den Avatar eines Patienten während der Erfassung seiner Bewegungsdaten, gefolgt von dem Avatar der muskuloskelettalen Simulation und einer Abbildung typischer Kräfte und Momente im Knie des Patienten während einer Gangübung.
Zusammen mit dem aus den klinischen Bilddaten gewonnenen Computermodell der zugehörigen Frakturversorgung und der Frakturmorphologie, kann nun die interfragmentäre Bewegung des Frakturspaltes in einem hoch personalisierten Kontext simuliert und analysiert werden.

Abbildung 3 zeigt den Betrag der Dehnungskomponenten während eines Vorwärtsschrittes des Patienten. Man erkennt, dass sich die sichtbaren Bereiche auf den Frakturspalt konzentrieren. Dies spiegelt auch den hohen Unterschied zwischen den Materialparametern des steifen Knochens und dem mit Weichgewebe gefüllten Frakturbereich wider.

Abbildung 4 zeigt die Verteilung der von Mises Vergleichsspannung auf dem Marknagel ebenfalls während eines Vorwärtsschrittes. Vergleicht man den Bereich mit den höchsten Werten der von Mises Vergleichsspannung mit der Illustration des Computermodells aus Abbildung 1, erkennt man, dass dieser Bereich auf dem Implantat genau auf der Höhe der Fraktur liegt. Eine eingehende mechanische Analyse der verschiedenen Dehnungsgrößen, in Verbindung mit der Spannungsverteilung des Implantates, liefert wichtige Hinweise auf einen potentiellen Heilungsverlauf.
Ein wesentliches Ziel dieses Projektes ist eine weitergehende Automatisierung der einzelnen Prozessschritte, sowie die darauf aufbauende Etablierung von Simulationswerkzeugen im klinischen Alltag. Um diesem Ziel näher zu kommen, werden innerhalb des Projektes ständig einzelne Komponenten des Workflows in der Universitätsklinik des Saarlandes getestet und in klinische Studien integriert.
Publikationen dieses Projekts
C. Schlinkmann, M. Roland, C. Wolff, P. Trampert, P. Slusallek, S. Diebels, T. Dahmen „A GPU-based caching strategy for multimaterial linear elastic FEM on regular grids” PLoS One 15(10) e0240813 (2020)